Алюминий – «серебро из глины». Презентация по химии на тему «История открытия алюминия»
Что представляет собой

Алюминий – это металл, элемент периодической системы Д. И. Менделеева №13. Простое вещество с формулой из одного символа – Al.
Международное обозначение – Al (Aluminium).
Структура решетки – куб, центрированный по граням.
Цвет изначально белый, но на воздухе создается серебристо-матовая пленка-оксид.
По классификации цветных металлов причислен к группе легких (вместе с титаном и магнием).
Алюминий – самый распространенный в земной коре среди металлов и третий среди химических элементов, вслед за кислородом и кремнием.
Нахождение в природе, получение:
По распространенности в природе занимает 1-е среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Содержание алюминия в земной коре по данным различных исследователей составляет от 7,45% до 8,14% от массы земной коры. В природе алюминий встречается только в соединениях (минералах).
Корунд: Al2O3 — относится к классу простых оксидов, и иногда образует прозрачные драгоценные кристаллы — сапфира, и, с добавлением хрома, рубина. Накапливается в россыпях.
Бокситы: Al2O3*nH2O — осадочные алюминиевые руды. Содержат вредную примесь — SiO2. Бокситы служат важным сырьем для получения алюминия, а также красок, абразивов.
Каолинит: Al2O3*2SiO2*2H2O — минерал подкласса слоистых силикатов, главная составная часть белой, огнеупорной, и фарфоровой глины.
Современный метод получения алюминия был разработан независимо американцем Чарльзом Холлом и французом Полем Эру. Он заключается в растворении оксида алюминия Al2O3 в расплаве криолита Na3AlF3 с последующим электролизом с использованием графитовых электродов. Такой метод получения требует больших затрат электроэнергии, и поэтому оказался востребован только в XX веке. Для производства 1 т алюминия требуется 1,9 т глинозёма и 18 тыс. кВт·ч электроэнергии.
Как был открыт
Бокситы и глинозем известны людям веками. С алюминием как металлом они познакомились только к середине XIX века.
Мировой опыт
История открытия – это опыты ученых-одиночек:
- Первую попытку предпринял Парацельс (XVI век). Он выделил из квасцов «квасцовую землю», содержащую оксид неизвестного металла (алюминия).
- Два века спустя процесс повторил немецкий химик Андреас Маргграф. Тоже получил оксид металла, которому присвоил название alumina («вяжущий»).
- Первые миллиграммы металла выделил датчанин Ганс Эрстед. Физик-практик выбрал исходником хлорид алюминия. Нагревая и воздействуя калийной амальгамой, получил чистый металл.
- Чистый калий, а не амальгаму использовал Фридрих Велер. Восстановив металл (получилось несколько крупинок), описал его свойства.
- Еще дальше пошел француз Сент-Клер Девиль. Он изготовил слиток металла, использовав метод Велера. Но вместо калия взял натрий. Девиль предъявил слиток публике на Всемирной выставке в Париже (1855 год), сотворив сенсацию. Спустя год получил металл методом электролиза. Такой успех объясним: ученого спонсировал сам Наполеон III, рассчитывавший приспособить металл для военных нужд.
Получение металла промышленными партиями – заслуга американца Чарльза Холла и француза Поля Эру. Независимо друг от друга они к 1886 году разработали методику расплава глинозема в криолите электролизом.
Металл в России
С глиноземом экспериментировали и русские ученые. Метод, предложенный К.И.Байером, стал классическим для алюминиевой промышленности мира.
Первый алюминиевый завод – Волховский – ввели в строй во времена СССР (1932 год).
Производство сырья исчислялось тысячами тонн. Эта отрасль была на особом счету: ее продукт обеспечивал обороноспособность государства.
Сегодня монополист по добыче и переработке сырья – компания «Русал» («Русский Алюминий»).
Новое «золото»
Первый алюминий был дороже золота:
- Европейская знать использовала алюминиевые столовые приборы (гостям попроще выдавались серебряные или золотые). Моду задал своим указом император Франции Наполеон III.
- Ювелиры изготавливали украшения класса люкс.
- Бесценный подарок сделали англичане русскому гению Дмитрию Менделееву – весы с чашами из золота и алюминия.
Дешевый метод появился к началу ХХ века. В 1911 году во французском Дюрене выпустили первую партию металла. Его назвали в честь этого города. А алюминий перешел в разряд бижутерии.
История названия
Латинский термин восходит к корню alumen. Так назывались квасцы, издревле используемые лекарями.
В России металл именовали «серебром из глины», поскольку глинозем – главный компонент глины.
Металл в природе
7,4-8,1% земной коры – это алюминий. В природе представлен горными породами и минералами, формирующими земную кору.
Почти всегда это соединения алюминия:
- Бокситы (оксиды с примесью кремния, кальция, железа).
- Глиноземы (каолиново-песчаная либо известковая, магнезиальная смесь).
- Нефелины (с калием).
- Каолиниты.
- Корунды.
В сегменте корундов соседствуют «суровый» наждак и ювелирные минералы: сапфир, рубин. Строение их решеток идентично.
«Алюминиевые» самоцветы: сапфир, рубин, изумруд, аквамарин, александрит.
Соединения алюминия найдены в воде рек, морей, океанов. В чистом виде – только в жерлах вулканов.
Месторождения и методы добычи
Главное сырье для получения алюминия – бокситы. Их залежи сосредоточены в тропиках и субтропиках.

Добыча алюминия
Россия богата нефелиновыми рудами, источник которых – север страны (Кольский полуостров и Кемеровская область).
Мировые запасы сырья исчисляются миллионами тонн.
Добыча ведется открытым либо закрытым способом.
Минералы, месторождения…а самородный алюминий?
Запасы алюминия в природе огромны. Среди металлов он держит первое место по распространенности. Но «общительность», активность элемента привела к тому, что в чистом виде металл практически отсутствует.
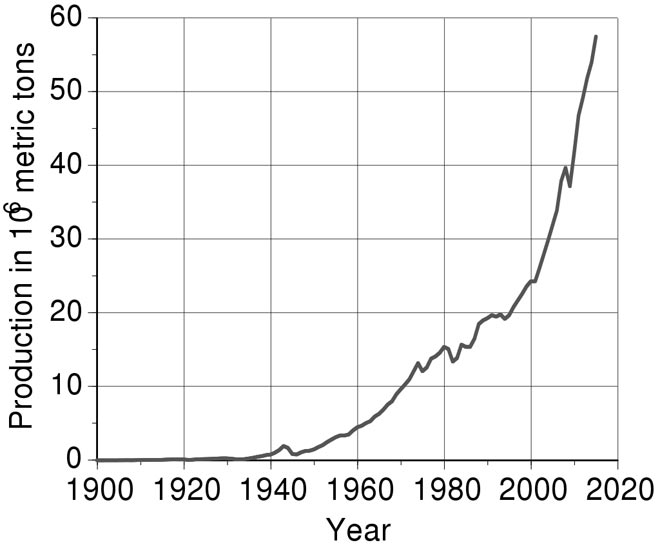
Производство алюминия в миллионах тонн
Минералов, содержащих алюминий, много:
- бокситы;
- глиноземы;
- полевые шпаты;
- нефелины;
- корунды.
Так что добыча алюминиевого сырья не составляет большого труда.
Если все запасы на Земле истощатся (что сомнительно), то алюминий можно добывать из морской воды. Там его содержание составляет 0,01 мг/л.
Кто захочет увидеть самородный алюминий, тому придется опускаться в жерла вулканов.
Происхождением такой металл из самых глубин нашей планеты.
ЗАПАСЫ И ДОБЫЧА

Кусочки алюминия
По распространённости в земной коре Земли занимает 1-е место среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Массовая концентрация алюминия в земной коре, по данным различных исследователей, оценивается от 7,45 до 8,14%.
Современный метод получения, процесс Холла—Эру был разработан независимо американцем Чарльзом Холлом и французом Полем Эру в 1886 году. Он заключается в растворении оксида алюминия Al2O3 в расплаве криолита Na3AlF6 с последующим электролизом с использованием расходуемых коксовых или графитовых анодных электродов. Такой метод получения требует очень больших затрат электроэнергии, и поэтому получил промышленное применение только в XX веке.
Физико-химические характеристики
Для практических целей важны следующие свойства алюминия:
- Теплопроводность (выше только у меди и серебра).
- Легкость, пластичность.
- Электропроводность (впереди только медь, золото и серебро).
- Неуязвимость к коррозии. Это свойство обеспечивает прочная пленка-оксид, которой на воздухе покрывается металл. Дальше он не окисляется. Взаимодействие с металлами, кислотами, водой нулевое. При удалении пленки химическая активность восстанавливается.
- Холодостойкость (на морозе не становится хрупким).
| Алюминий / Aluminium (Al), 13 |
| 13, 3, |
| 26,9815386(8) а. е. м. (г/моль) |
| [Ne] 3s2 3p1 |
| 2, 8, 3 |
| 143 пм |
| 121 ± 4 пм |
| 184 пм |
| 51 (+3e) пм |
| 1,61 (шкала Полинга) |
| −1,66 В |
| 1‑я: 577,5 (5,984) кДж/моль (эВ)
2‑я: 1816,7 (18,828) кДж/моль (эВ) |
| Твёрдое вещество |
| 2,6989 г/см³ |
| 660 °C, 933,5 K |
| 2518,82 °C, 2792 K |
| 10,75 кДж/моль |
| 284,1 кДж/моль |
| 24,35 24,2 Дж/(K·моль) |
| 10,0 см³/моль |
| кубическая гранецентрированая |
| 4,050 Å |
| 394 K |
| (300 K) 237 Вт/(м·К) |
| 5200 м/с |
| 7429-90-5 |
Наконец, с ним легко работается. Металл подходит для любого вида обработки (штамповка, волочение, ковка, прокат, полировка).

Микроструктура алюминия на протравленной поверхности слитка, чистотой 99,9998 %
Важнейшие соединения:
Оксид алюминия,
Al2O3: твердое, тугоплавкое вещество белого цвета. Кристаллический Al2O3 химически пассивен, аморфный — более активен. Медленно реагирует с кислотами и щелочами в растворе, проявляя амфотерные свойства:
Al2O3 + 6НСl(конц.) = 2АlСl3 + ЗН2О
Al2O3 + 2NаОН(конц.) + 3Н2О = 2Na[Al(OH)4]
(в расплаве щелочи образуется NaAlO2).
Гидроксид алюминия, Al(OH)3: белый аморфный (гелеобразный) или кристаллический. Практически не растворим в воде. При нагревании ступенчато разлагается. Проявляет амфотерные, равно выраженные кислотные и основные свойства.
При сплавлении с NaOH образуется NaAlO2. Для получения осадка Аl(ОН)3 щелочь обычно не используют (из-за легкости перехода осадка в раствор), а действуют на соли алюминия раствором аммиака — при комнатной температуре образуется Аl(ОН)3
Соли алюминия. Соли алюминия и сильных кислот хорошо растворимы в воде и подвергаются в значительной степени гидролизу по катиону, создавая сильнокислотную среду, в которой растворяются такие металлы, как магний и цинк:
Al3+ + H2O =AlOH2+ + H+
Нерастворимы в воде фторид AlF3 и ортофосфат АlРO4, а соли очень слабых кислот, например Н2СО3, вообще не образуются осаждением из водного раствора.
Известны двойные соли алюминия — квасцы состава MAl(SO4)2*12H2O (M=Na+, K+, Rb+, Cs+, ТI+, NH4+), самые распространенные из них алюмокалиевые квасцы KAl(SO4)2*12Н2O.
Растворение амфотерных гидроксидов в щелочных растворах рассматривается как процесс образования гидроксосолей (гидроксокомплексов). Экспериментально доказано существование гидроксомплексов [Аl(ОН)4(Н2О)2] -, [Аl(ОН)6]3-, [Аl(ОН)5(Н2O)]2-; из них первый — наиболее прочный. Координационное число алюминия в этих комплексах равно 6, т.е. алюминий является шестикоординированным.
Бинарные соединения алюминия
Соединения с преимущественно ковалентными связями, например сульфид Al2S3 и карбид Аl4С3 полностью разлагаются водой:
Al2S3 + 6Н2О = 2Аl(ОН)3 + 3Н2S Аl4С3 + 12H2O = 4Аl(ОН)3 + 3СН4
Физические свойства
Металл алюминий характеризуется высокой электропроводностью, теплопроводностью, стойкостью к коррозии и морозу, пластичностью. Он хорошо поддаётся штамповке, ковке, волочению, прокатке. Алюминий хорошо сваривается различными видами сварки. Важным свойством является малая плотность около 2,7 г/см³. Температура плавления составляет около 660°С.
Механические, физико-химические и технологические свойства алюминия зависят от наличия и количества примесей, которые ухудшают свойства чистого металла. Основные естественные примеси – это кремний, железо, цинк, титан и медь.
По степени очистки различают алюминий высокой и технической чистоты. Практическое различие заключается в отличии коррозионной устойчивости к некоторым средам. Чем чище металл, тем он дороже. Технический алюминий используется для изготовления сплавов, проката и кабельно-проводниковой продукции. Металл высокой чистоты применяют в специальных целях.
По показателю электропроводности алюминий уступает только золоту, серебру и меди. А сочетание малой плотности и высокой электропроводности позволяет конкурировать в сфере кабельно-проводниковой продукции с медью. Длительный отжиг улучшает электропроводность, а нагартовка ухудшает.
Теплопроводность алюминия повышается с увеличением чистоты металла. Примеси марганца, магния и меди снижают это свойство. По показателю теплопроводности алюминий проигрывает только меди и серебру. Благодаря этому свойству металл применяется в теплообменниках и радиаторах охлаждения.
Алюминий обладает высокой удельной теплоёмкостью и теплотой плавления. Эти показатели значительно больше, чем у большинства металлов. Чем выше степень чистоты алюминия, тем больше он способен отражать свет от поверхности. Металл хорошо полируется и анодируется.
Алюминий имеет большое сродство к кислороду и покрывается на воздухе тонкой прочной плёнкой оксида алюминия. Эта плёнка защищает металл от последующего окисления и обеспечивает его хорошие антикоррозионные свойства. Алюминий обладает стойкостью к атмосферной коррозии, морской и пресной воде, практически не вступает во взаимодействия с органическими кислотами, концентрированной или разбавленной азотной кислотой.
Применение
Алюминий применяется в металлургии в качестве основы для сплавов (дуралюмин, силумин) и легирующего элемента (сплавы на основе меди, железа, магния, никеля). Сплавы алюминия используются в быту, в архитектуре и строительстве, в судостроении и автомобилестроении, а также в космической и авиационной технике. Алюминий применяется при производстве взрывчатых веществ. Анодированный алюминий (покрытый окрашенными плёнками из оксида алюминия) применяют для изготовления бижутерии. Также металл используется в электротехнике.
Рассмотрим, как используют различные изделия из алюминия.
Алюминиевая лента представляет собой тонкую алюминиевую полосу толщиной 0,3-2 мм, шириной 50-1250 мм, которая поставляется в рулонах. Используется лента в пищевой, лёгкой, холодильной промышленности для изготовления охлаждающих элементов и радиаторов.
Круглая алюминиевая проволока применяется для изготовления кабелей и проводов для электротехнических целей, а прямоугольная для обмоточных проводов.
Алюминиевые трубы отличаются долговечностью и стойкостью в условиях сельских и городских промышленных районов. Применяются они в отделочных работах, дорожном строительстве, конструкции автомобилей, самолётов и судов, производстве радиаторов, трубопроводов и бензобаков, монтаже систем отопления, магистральных трубопроводов, газопроводов, водопроводов.
Алюминиевые втулки характеризуются простотой в обработке, монтаже и эксплуатации. Используются они для концевого соединения металлических тросов.
Алюминиевый круг — это сплошной профиль круглого сечения. Используется это изделие для изготовления различных конструкций.
Алюминиевый пруток применяется для изготовления гаек, болтов, валов, крепежных элементов и шпинделей.
Около 3 мг алюминия каждый день поступает в организм человека с продуктами питания. Больше всего металла в овсянке, горохе, пшенице, рисе. Учёными установлено, что он способствует процессам регенерации, стимулирует развитие и рост тканей, оказывает влияние на активность пищеварительных желёз и ферментов.
Алюминиевый лист
Алюминиевая плита
Алюминиевые чушки
Алюминиевые уголки
Алюминиевая проволока
При использовании алюминиевой посуды в быту необходимо помнить, что хранить и нагревать в ней можно исключительно нейтральные жидкости. Если же в такой посуде готовить, к примеру, кислые щи, то алюминий поступит в еду, и она будет иметь неприятный «металлический» привкус.
Алюминий входит в состав лекарственных препаратов, используемых при заболеваниях почек и желудочно-кишечного тракта.
СТАТЬИ ПРО СПЛАВЫ
- Медь
- Латунь
- Латунь Л63
- Латунь ЛС59-1
- Бронза
- Сплав БрБ2
- Сплав БрАЖ9-4
- Сплав БрАЖН10-4-4
- Сплав БрОФ
- Cплав БрОЦ4-3
- Сплав БрОЦС4-4-2,5
- Сплав БрОЦС5-5-5
- Сплав БрАЖМц
- Алюминий
- Сплав АК7
- Сплав АД31
- Сплав В95
- Сплав Д16
- Сплав АК12 (АЛ2)
- Сплав АК4
- Сплав Д16т
- Сплав АМг3
- Титан
Ваше имя*
Номер телефона*
Ваш заказ: Алюминий
Количество*
Ваше имя*
Ваш телефон*
Ваш email*
Комментарий к заказу
<текстареа name="message" rows="3" eform="Комментарий:string:0">
КЛАССИФИКАЦИЯ
Hey’s CIM Ref1.21
| Strunz (8-ое издание) | 1/A.03-05 |
| Nickel-Strunz (10-ое издание) | 1.AA.05 |
| Dana (7-ое издание) | 1.1.22.1 |
| Dana (8-ое издание) | 1.1.1.5 |
Алюминий в таблице Менделеева
В таблице Д. И. Менделеева элемент располагается под 13 номером. Ему соответствует III период, 3 группа, главная подгруппа. Он находится между магнием – металлом, и кремнием – неметаллом. Поэтому соединение алюминия проявляют амфотерные свойства.

Обозначается вещество латинскими буквами Al (по началу иностранного слова). Такое же обозначение соответственно используется в формулах реакций алюминия.
ПРОИСХОЖДЕНИЕ

Аллюминий, агрегированный с коркой байерита на поверхности. Узбекистан, Навойская область, Учкудук
Вследствие высокой химической активности он не встречается в чистом виде, а лишь в составе различных соединений. Так, например, известно множество руд, минералов, горных пород, в состав которых входит алюминий. Однако добывается он только из бокситов, содержание которых в природе не слишком велико. Самые распространенные вещества, содержащие рассматриваемый металл: полевые шпаты; бокситы; граниты; кремнезем; алюмосиликаты; базальты и прочие. В небольшом количестве алюминий обязательно входит в состав клеток живых организмов. Некоторые виды плаунов и морских обитателей способны накапливать этот элемент внутри своего организма в течение жизни.
Способы получения
Бокситная руда – это глинозем (45-58%) плюс соединения железа, титана, кремнезем. Ее транспортируют на обогатительную фабрику.
Для очистки глинозема применяют процесс К.И.Байера:
- Руду загружают в автоклав, где нагревают с едким натром, охлаждают.
- Отделяют твердый осадок.
- Гидроокись осаждают, прокаливают.
На выходе получают оксид алюминия, то есть чистый глинозем. Его тестируют на калибровку и чистоту, затем превращают в алюминий.
Свойства алюминия делают невозможным применение классических для металлов способов восстановления.

Сегодня металл высвобождают способом, придуманным в конце XIX века (метод Холла-Эру).
Изучается возможность производства металлического алюминия через частичное восстановление. Образуется карбид алюминия, который разлагают при 1950°С. По расчетам, он рентабельнее классического.
Из нефелинов попутно получают кальцинированную соду, поташ, цемент, удобрения.
Алюминий vs медь
Эти металлы – соперники на рынке. У каждого свои достоинства и недостатки.
Главные конкурентные преимущества алюминия – легкость, пластичность, дешевизна (втрое по сравнению с медью).
Медь отличается более высокой тепло- и электропроводностью.
ОПТИЧЕСКИЕ СВОЙСТВА
Плеохроизмне плеохроирует
| Тип | изотропный |
| Люминесценция в ультрафиолетовом излучении | не флюоресцентный |
| Магнетизм | парамагнетик |
Как производят крылатый металл
Производство металла можно разделить на две стадии.
- Первая — добыча бокситов, их дробление и отделение кремния при помощи пара.
- Вторая стадия: глинозем смешивают с расплавленным криолитом и воздействуют на смесь электротоком. В процессе реакции жидкий алюминий оседает на дне ванны.
Образовавшийся металл отливают в слитки; далее он отправляется потребителям или на производство сплавов и высокочистого алюминия.
Метод энергозатратный, «кушает» много электричества.
Бывает технический и сверхчистый
Полученный алюминий называется техническим или нелегированным. В нем содержание чистого металла не менее 99%. Его потребляет электронная промышленность, он необходим в производстве теплообменных и нагревательных устройств, осветительного оборудования.
Часть этого металла отправляется на дополнительную очистку, «рафинирование». В результате имеем металл высокой чистоты, с содержанием алюминия не менее 99,995%.
Его употребляют в электронике, в производстве полупроводников. Кабельное производство, химическое машиностроение сейчас не обойдется без сверхчистого алюминия.
Интересно: до открытия промышленного способа получения алюминия он был редкостью и стоил дороже золота. Нашего великого химика, Д.И. Менделеева, британцы почтили подарком. Это были аналитические весы (вещь, незаменимая для химика), у которых чашечки изготовили из золота и алюминия.
Металл для крыльев
Без такого металла, как алюминий, невозможно покорение неба. Крыльев людям не дано, а летать хочется человеку с давних времен. Не напрасно миф об Икаре живет с античных времен. Попытки взлететь предпринимались неоднократно.
Но прорыв случился в 1903 году, когда романтики неба и замечательные механики братья Райт подняли в воздух самолетик. Этот самолет открыл путь в небо.
Где используется
Характеристики алюминия обусловили его применение во всех отраслях хозяйства – от ракетостроения до производства пищевой фольги.
По степени чистоты металла различают два вида: технический и высокой чистоты.
Промышленность
Металл используют как конструкционный материал и восстановитель.
Например, трубы из него долговечны, надежны. Кроме магистральных газо-, водопроводов, радиаторов отопления, это элементы бензобаков, автомобилей, самолетов, судов. Их используют декораторы и укладчики дорог.

Металлургия
Металл применяется как базис для сплавов. В отличие от природных примесей, сплавы создаются людьми. Их искусственное происхождение обнуляет природные недостатки материала. Например, медь и магний повышают порог прочности.
Алюминиевых сплавов сотни, самые известные:
- дюралюминий – плюс медь, магний;
- силумин – плюс кремний.
Другие легирующие элементы – железо, никель.
Как мощный раскислитель задействован в производстве сталей. Благодаря ему исключена пористость отливок и слитков.
Им восстанавливают редкие металлы из их соединений.
Электротехника
Это оптимальный материал для ассортимента изделий:
- Провода, кабели, тепловое оборудование.
- Холодильные, другие криогенные системы.
- Клапаны двигателей внутреннего сгорания, нефтяных платформ, турбин.
Алюминий заменяет затратный процесс цинкования.
Энергетика
Металл выступает универсальным вторичным энергоносителем для выработки тепла, производства водорода, электричества для электрохимических генераторов.
Применяется в теплообменниках, радиаторах охлаждения.
Строительство
Газообразующий агент, благодаря которому возможно получение пористого строительного материала.
Технологи работают над созданием пенистого алюминия – сверхлегкого, сверхпрочного материала нового поколения.
ВПК, авиация и космонавтика
Из алюминия сделан первый самолет (1919 год). Сегодня это сырье номер один в авиа- и ракетостроении. Он есть в корпусах самолетов, ракет, спутников.
Алюминий и его соединения – основа либо компонент топлива для ракет.
Дешевый легкий металл приспособили для производства автоматов, гранатометов, пистолетов, взрывчатки.
Другие отрасли
Металл популярен в «мирных» сегментах.
Пищевая промышленность
В пищепроме это упаковка продуктов питания, фольга для кулинарных целей (например, запекания в духовке).

Алюминий – это пищевая добавка Е173.
Столовые приборы для общепита, армии (котелки, фляги), пенитенциарных заведений тоже алюминиевые.
Медицина
Алюмогель – основа препаратов при проблемах желудочно-кишечного тракта. Самые известные – Маалокс, Альмагель.
Ювелирное дело
Ювелиры любили алюминий: его легко обрабатывать, а пленка на поверхности придает сходства с благородной патиной.
Но эти времена прошли. Сегодня металл в почете только у японцев. Мастера выполняют традиционные украшения для причесок, одежды. Они проходят как бижутерия, заменяя элитарное серебро.
Мода прихотлива: сегодня появились украшения класса люкс из бетона как оправы. Так что всплеск популярности ювелирного алюминия не исключен.
Предостережение
Алюминий не заложен изначально в биологические организмы. Но человек получает его микродозы ежедневно – с пищей.
Им богаты горох, пшеница, рис, овсяный «геркулес». Доказана польза алюминия как стимулятора регенерации, развития тканей, работы ЖКТ, ферментов.
Однако его переизбыток (откладывается в костях, мозге, печени, почках) чреват тяжелыми расстройствами нервной системы.
По стандартам РФ, в литре питьевой воды не должно быть более 0,2 мг алюминия.
Алюминиевой посудой пользоваться можно, но ограниченно. Безопасны готовка, подогрев, хранение продуктов с нейтральными характеристиками. Приготовление кислых блюд (щи, томат, компот) опасно. Алюминий поступит в еду, создавая избыточную дозу при попадании в организм, плюс «железный» привкус.
Где применяется
Применение легкого и прочного металла необходимо не только в авиации.

Алюминиевый прокат
В пуленепробиваемых и бронированные стеклах, экранчиках смартфонов присутствует сапфир. У таких стекол высокая прочность на сжатие.
Познавательно: ученые продолжают разработку видов стекол, обладающих противопульной устойчивостью при меньших толщине и весе. Перспективным направлением считается прозрачная броня на основе монокристалла сапфира.
Из алюминия делают фольгу, которую используют в электрических конденсаторов. Домохозяйки с удовольствием запекают в фольге вкусняшки для домашних. Кастрюли, сковородки, другие изделия для домашнего хозяйства производят из «крылатого металла».

Посуда из алюминия
Тонко молотый порошок металла используют для производства прочной краски.
Вы удивитесь, но алюминиевая кастрюлька в кухне, самолет и перстень с сапфиром — родня. В каждом есть наш герой.
Удивительно: железнодорожный транспорт на треть возит сам себя. Вес груженого товарного вагона на треть состоит из веса вагона. Про пассажирские вагоны и говорить нечего, вес людей в них всего 5%, остальное приходится на вагон.
Оксид алюминия — это корунд. А к ним относятся сапфиры, рубины, изумруды — все эти короли драгоценных камней содержат алюминий. Сам корунд используют как наждак.
Строение атома алюминия
Относительная атомная масса равна 27. Количество протонов (p) и электронов (e) одинаково, его указывает порядковый номер: 13. Нейтроны равны разности относительной атомной массы алюминия и номера элемента в таблице Д. И. Менделеева: 27-13=14.
Атом состоит из ядра, с зарядом +13, и 3 электронных оболочек. Все положительные протоны находятся в ядре, а электроны распределены по 3 уровням. На первом – 2, втором – 8, на третьем – 3 валентных частицы.
Электронная формула алюминия представлена на рисунке ниже.

Но в возбужденном состоянии валентные электроны третьего подуровня s перемещаются на внешний p уровень.
Химические свойства
Алюминий — это достаточно активный амфотерный металл. При обычных условиях прочная оксидная плёнка определяет его стойкость. Если разрушить оксидную плёнку, алюминий выступает как активный металл-восстановитель. В мелкораздробленном состоянии и при высокой температуре металл взаимодействует с кислородом. При нагревании происходят реакции с серой, фосфором, азотом, углеродом, йодом. При обычных условиях металл взаимодействует с хлором и бромом. С водородом реакции не происходит. С металлами алюминий образует сплавы, содержащие интерметаллические соединения – алюминиды.
При условии очищения от оксидной пленки, происходит энергичное взаимодействие с водой. Легко протекают реакции с разбавленными кислотами. Реакции с концентрированной азотной и серной кислотой происходят при нагревании. Алюминий легко реагирует со щелочами. Практическое применение в металлургии нашло свойство восстанавливать металлы из оксидов и солей – реакции алюминотермии.