2.2.2. Химические свойства металлов IIA группы. Оксид бария: получение и применение
Взаимодействие с простыми веществами
с кислородом
Без нагревания бериллий и магний не реагируют ни с кислородом воздуха, ни с чистым кислородом ввиду того, что покрыты тонкими защитными пленками, состоящими соответственно из оксидов BeO и MgO. Их хранение не требует каких-либо особых способов защиты от воздуха и влаги, в отличие от щелочноземельных металлов, которые хранят под слоем инертной по отношению к ним жидкости, чаще всего керосина.
Be, Mg, Ca, Sr при горении в кислороде образуют оксиды состава MeO, а Ba – смесь оксида бария (BaO) и пероксида бария (BaO2):
2Mg + O2 = 2MgO
2Ca + O2 = 2CaO
2Ba + O2 = 2BaO
Ba + O2 = BaO2
Следует отметить, что при горении щелочноземельных металлов и магния на воздухе побочно протекает также реакция этих металлов с азотом воздуха, в результате которой, помимо соединений металлов с кислородом, образуются также нитриды c общей формулой Me3N2.
с галогенами
Бериллий реагирует с галогенами только при высоких температурах, а остальные металлы IIA группы — уже при комнатной температуре:
Мg + I2 = MgI2 – иодид магния
Са + Br2 = СаBr2 – бромид кальция
Ва + Cl2 = ВаCl2 – хлорид бария
с неметаллами IV–VI групп
Все металлы IIA группы реагируют при нагревании со всеми неметаллами IV–VI групп, но в зависимости от положения металла в группе, а также активности неметаллов требуется различная степень нагрева. Поскольку бериллий является среди всех металлов IIA группы наиболее химически инертным, при проведении его реакций с неметаллами требуется существенно большая температура.
Следует отметить, что при реакции металлов с углеродом могут образовываться карбиды разной природы. Различают карбиды, относящиеся к метанидам и условно считающимися производными метана, в котором все атомы водорода замещены на металл. Они так же, как и метан, содержат углерод в степени окисления -4, и при их гидролизе или взаимодействии с кислотами-неокислителями одним из продуктов является метан. Также существует другой тип карбидов – ацетилениды, которые содержат ион C22-, фактически являющийся фрагментом молекулы ацетилена. Карбиды типа ацетиленидов при гидролизе или взаимодействии с кислотами-неокислителями образуют ацетилен как один из продуктов реакции. То, какой тип карбида – метанид или ацетиленид — получится при взаимодействии того или иного металла с углеродом, зависит от размера катиона металла. С ионами металлов, обладающих малым значением радиуса, образуются, как правило, метаниды, с ионами более крупного размера – ацетилениды. В случае металлов второй группы метанид получается при взаимодействии бериллия с углеродом:
Остальные металлы II А группы образуют с углеродом ацетилениды:
С кремнием металлы IIA группы образуют силициды — соединения вида Me2Si, с азотом – нитриды (Me3N2), фосфором – фосфиды (Me3P2):
с водородом
Все щелочноземельные металлы реагируют при нагревании с водородом. Для того чтобы магний прореагировал с водородом, одного нагрева, как в случае со щелочноземельными металлами, недостаточно, требуется, помимо высокой температуры, также и повышенное давление водорода. Бериллий не реагирует с водородом ни при каких условиях.
Состав
Оксид бария BaO состоит из катиона Ba.2+ и анион кислорода O2–.

В своих кристаллах BaO образует кубические ионные сетки (кубической формы) типа хлорида натрия.

Электронная конфигурация иона бария: [Xe] 6s0 поскольку он потерял два электрона оболочки 6s. Эта конфигурация очень стабильна.
В качестве осушителя органических растворителей
Из-за легкости взаимодействия с водой BaO используется с середины прошлого века в качестве осушителя бензина и основных или нейтральных органических растворителей.
BaO очень активно высыхает вокруг себя, он очень быстро впитывает влагу, выделяя значительное количество тепла, образуя гидроксид бария Ba (OH).2 который стабилен примерно до 1000 ºC. Поэтому BaO можно использовать при высоких температурах.
Он также обладает высокой водопоглощающей способностью. Каждая молекула BaO может абсорбировать одну из воды и Ba (OH).2 В результате также может впитаться определенное количество воды.
Подходит для лабораторий аналитической химии. Он не липкий.
Его можно использовать в эксикаторах, которые представляют собой большие стеклянные контейнеры с крышкой, в которых внутренняя среда остается сухой. BaO сохраняет миниатюрную атмосферу эксикатора сухой.

Эти эксикаторы используются для размещения веществ или реагентов и, таким образом, предотвращения поглощения ими воды из окружающей среды.
Он также используется для осушения основных газов, таких как аммиак NH.3.
Области применения оксидов основного типа
Любое их химических соединений данной группы широко применяется в различных отраслях современной промышленности. В соответствии с краткой классификацией веществ, можно определить следующее разграничение использования оксидов (калия, магния, бария, алюминия):
- • Оксид калия. Широко применяется в производстве удобрений минерального типа, используемых аграрном хозяйстве;
- • Оксид натрия. Незаменим в химической промышленности для получения гидроксида натрия;
- • Оксид бария. Применим в качестве катализатора в осуществлении химических реакций;
- • Оксид магния. Область применения – пищевая промышленность (в виде добавки Е530).
Хранение
Условия соответствующего хранения ВаО подразумевают полное отсутствие любых легко возгораемых веществ. Также исключены в близком хранении и нахождении восстанавливающие агенты, металлы в порошкообразном состоянии. Категорически запрещается параллельное нахождение любых продуктов питания и сельскохозяйственных животных кормов.
При приготовлении цементных смесей
BaO был протестирован как компонент фосфоалюминатного цемента.
Этот тип цемента полезен в морской среде, поскольку он не имеет такой же тенденции к гидратации, как другие типы цемента, поэтому он не страдает от образования пор или расширения.
Тем не менее, фосфоалюминатные цементы должны быть усилены по своим механическим характеристикам, чтобы они могли противостоять морским течениям и ударам плавающих кусков льда, присутствующих в океане.
Добавление BaO к фосфоалюминатному цементу изменяет минеральную структуру указанного материала, улучшает структуру пор и значительно увеличивает прочность на сжатие цементного теста.
Другими словами, BaO улучшает прочность на сжатие этого типа цемента.

Общие сведения:
| 100 | Общие сведения | |
| 101 | Название | Оксид бария |
| 102 | Другие названия | |
| 103 | Латинское название | |
| 104 | Английское название | |
| 105 | Химическая формула | BaO |
| 106 | Тип | Неорганическое вещество |
| 107 | Группа | |
| 108 | Открыт | |
| 109 | Год открытия | |
| 110 | Внешний вид и пр. | |
| 111 | Происхождение | |
| 112 | Модификации | |
| 113 | Аллотропные модификации | |
| 114 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 115 | Конденсат Бозе-Эйнштейна | |
| 116 | Двумерные материалы | |
| 117 | Содержание в атмосфере и воздухе (по массе) | |
| 118 | Содержание в земной коре (по массе) | |
| 119 | Содержание в морях и океанах (по массе) | |
| 120 | Содержание во Вселенной и космосе (по массе) | |
| 121 | Содержание в Солнце (по массе) | |
| 122 | Содержание в метеоритах (по массе) | |
| 123 | Содержание в организме человека (по массе) | |
| 124 | Молярная масса |
Точка кипения
Примерно 2000 ºC.
BaO + CO2 = ? уравнение реакции
Составьте химическое уравнение по схеме BaO + CO2 = ? Охарактеризуйте полученное соединение: приведите основные физические и химические свойства. Каким образом это вещество получают в лаборатории? А в промышленности?
В результате взаимодействия оксида бария с углекислым газом (BaO + CO2 = ?) происходит образование средней соли – карбоната бария (соединение). Молекулярное уравнение реакции имеет вид:
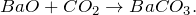
Карбонат бария представляет собой твердое вещество белого цвета, кристаллы которого при нагревании на воздухе разлагаются, а также способны плавиться под избыточным давлением углекислого газа. Не растворяется в воде. Частично переводится в раствор избытком оксида углерода (IV). Разлагается разбавленными кислотами.
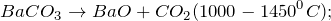
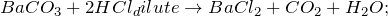
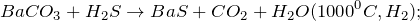
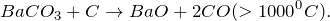
1000^<0>C).]» title=»Rendered by QuickLaTeX.com»/>
В промышленных масштабах карбонат бария получают из природных минералов, например, витерита. Среди лабораторных способов наиболее популярные обменные реакции, отвечающие сокращенному-ионному уравнению:
Источник
Температура плавления
1923 ºC
Определение химических свойств вещества на практике
• Ярко протекает реакция взаимодействия оксида бария и воды, вследствие чего отмечается образование щелочи с параллельным выделением тепла: ВаО + Н2О → Ва(ОН)2.
• Взаимодействует оксид бария и с кислотными оксидами, в результате чего характерно образование солей: ВаО + СО2 → ВаСО3, ВаО + SО3 → Ва SО4↓, где оксид бария вступает в реакцию с триоксидом серы;
• Реакция взаимодействия ВаО с кислотами, где обеспечивается итоговое образование солей и воды: ВаО + Н2Сl → ВаСl2 + Н2О, ВаО + Н2SО4 → Ва SО4↓ + Н2О. В течение подобной реакции между оксидом бария и серной кислотой (в разбавленном виде) результатом становится образование сульфата бария и воды.
Также стоит обратить внимание на реакцию оксида бария с соляной кислотой: ВаО + 2НСl (при обязательном условии разбавленного состояния) → ВаСl2 + Н2О, где результатом реакции обеспечено образование хлорида бария BaCl2 и воды H2O.
Взаимодействие со сложными веществами
с водой
Все щелочноземельные металлы активно реагируют с водой с образованием щелочей (растворимых гидроксидов металлов) и водорода. Магний реагирует с водой лишь при кипячении вследствие того, что при нагревании в воде растворяется защитная оксидная пленка MgO. В случае бериллия защитная оксидная пленка очень стойкая: с ним вода не реагирует ни при кипячении, ни даже при температуре красного каления:
c кислотами-неокислителями
Все металлы главной подгруппы II группы реагируют с кислотами-неокислителями, поскольку находятся в ряду активности левее водорода. При этом образуются соль соответствующей кислоты и водород. Примеры реакций:
Ве + Н2SO4(разб.) = BeSO4 + H2↑
Mg + 2HBr = MgBr2 + H2↑
Ca + 2CH3COOH = (CH3COO)2Ca + H2↑
c кислотами-окислителями
− разбавленной азотной кислотой
С разбавленной азотной кислотой реагируют все металлы IIA группы. При этом продуктами восстановления вместо водорода (как в случае кислот-неокислителей) являются оксиды азота, преимущественно оксид азота (I) (N2O), а в случае сильно разбавленной азотной кислоты – нитрат аммония (NH4NO3):
4Ca + 10HNO3(разб.) = 4Ca(NO3)2 + N2O↑ + 5H2O
4Mg + 10HNO3(сильно разб.) = 4Mg(NO3)2 + NН4NO3 + 3H2O
− концентрированной азотной кислотой
Концентрированная азотная кислота при обычной (или низкой) температуре пассивирует бериллий, т.е. в реакцию с ним не вступает. При кипячении реакция возможна и протекает преимущественно в соответствии с уравнением:
Магний и щелочноземельные металлы реагируют с концентрированной азотной кислотой с образованием большого спектра различных продуктов восстановления азота.
− концентрированной серной кислотой
Бериллий пассивируется концентрированной серной кислотой, т.е. не реагирует с ней в обычных условиях, однако реакция протекает при кипячении и приводит к образованию сульфата бериллия, диоксида серы и воды:
Be + 2H2SO4 → BeSO4 + SO2↑+ 2H2O
Барий также пассивируется концентрированной серной кислотой вследствие образования нерастворимого сульфата бария, но реагирует с ней при нагревании, сульфат бария растворяется при нагревании в концентрированной серной кислоте благодаря его превращению в гидросульфат бария.
Остальные металлы главной IIA группы реагируют с концентрированной серной кислотой при любых условиях, в том числе на холоду. Восстановление серы происходит преимущественно до сероводорода:
4Mg + 5H2SO4(конц.) = 4MgSO4 + H2S↑ + 4H2O
с щелочами
Магний и щелочноземельные металлы со щелочами не взаимодействуют, а бериллий легко реагирует как растворами щелочей, так и с безводными щелочами при сплавлении. При этом при осуществлении реакции в водном растворе в реакции участвует также и вода, а продуктами являются тетрагидроксобериллаты щелочных или щелочноземельных металлов и газообразный водород:
Be + 2KOH + 2H2O = H2↑ + K2[Be(OH)4] — тетрагидроксобериллат калия
При осуществлении реакции с твердой щелочью при сплавлении образуются бериллаты щелочных или щелочноземельных металлов и водород
Be + 2KOH = H2↑+ K2BeO2 — бериллат калия
Природные источники вещества
По содержанию в природных источниках различается несколько возможных:
- • Земная кора, где масса вещества составляет 0, 05 %;
- • Морская вода, где средняя величина содержания бария составляет 0,02 мг/литр.
Плотность
5,72 г / см3
В газоразрядных лампах
BaO помещается на электроды газоразрядных ламп как материал, излучающий электроны.
Газоразрядные лампы изготавливаются из трубки из стекла, кварца или другого подходящего материала, они содержат инертный газ и, в большинстве случаев, пары металла. Металлический пар может быть натрием или ртутью.

Электрические разряды возникают внутри трубки, потому что у нее есть положительный и отрицательный электроды.
BaO помещается на электроды лампы. Электроны, которые он испускает, сталкиваются с атомами пара металла и передают им энергию.
При прохождении электрического тока через этот газ или пар образуется видимый свет или ультрафиолетовое (УФ) излучение.
Химические свойства
Большинство бинарных соединений металла с кислородом проявляют основные свойства. Уравнение оксида бария (формула ВаО) показывает, что данное вещество относится именно к таким окислам. При этом данное соединение является солеобразующим. Типичные химические взаимодействия происходят со следующими классами веществ:
- Взаимодействие с водой происходит достаточно бурно, с выделением тепла и образование щелочного раствора. BaO + H2O = Ba(OH)2.
- С кислородом оксид взаимодействует при наличии катализатора (высокая температура 600-5000С), результатом является пероксид, разлагаемый в дальнейшем на составные части для выделения чистого металла или оксида. При этом необходимо увеличить нагрев до 7000С. 2Ba + O2 = 2BaO2.
- Как типичный основной оксид бария взаимодействует с кислотами, в результате химической реакции получается вода и соответствующая соль. BaO + H2SO4 = H2O + BaSO4 или BaO + 2HCI = H2O + BaCI2.
- Кислотные оксиды вступают в реакцию с BaO, результатом взаимодействия являются соли. BaO + CO2 = BaCO3 или BaO + SO3 = BaSO4.
- Для высвобождения чистого бария оксид прокаливают с металлами, которые забирают выделяемый кислород. В качестве таковых выступают кремний, алюминий, цинк или магний.
Степень растворимости Ва
Растворимость оксида бария определяется по реакции данного вещества с водой. В этом случае, исходя из данных уравнения по взаимодействию:
ВаО + Н2О = Ва(ОН)2,
где оксид бария — это оксид основного типа.
Следовательно такому оксиду будет соответствовать основание — Ва(ОН)2. Сверяя полученные данные с таблицей растворимости веществ нетрудно определить, что данный вид оснований относится к растворимым и подтверждает тот факт, что реакция вполне осуществима.

Влияние на человеческий организм
Барий не относится к жизненно важным микроэлементам. Его соединения могут быть опасны для здоровья и жизни человека, поэтому перед использованием окиси бария необходимо узнать о соответствующих мерах безопасности при работе с веществом.
Оксид металла считается высокотоксичным соединением. При отравлениях этим веществом у человека могут проявляться следующие симптомы:
- повышенное слюнотечение;
- чувство жжения в полости рта;
- дискомфорт в животе.
Интоксикация иногда сопровождается тошнотой или рвотой. Кроме того, пострадавшего могут беспокоить выраженные болезненные ощущения в области желудка или острые колики. Тяжёлое отравление может привести к летальному исходу, который обычно наступает в течение суток. Смертельная доза вещества для человека составляет около 0,8 г.
Кристаллические решётка:
| 300 | Кристаллическая решётка | |
| 311 | Кристаллическая решётка #1 | |
| 312 | Структура решётки | |
| 313 | Параметры решётки | |
| 314 | Отношение c/a | |
| 315 | Температура Дебая | |
| 316 | Название пространственной группы симметрии | |
| 317 | Номер пространственной группы симметрии |
Молекулярный вес
153,33 г / моль
Сфера применения
Поскольку выход BaO низок, он часто применяется в работах по покрытию катодов, которые входят в вакуумные приборы, на деталях телевизионных устройств и осциллографических трубок. Большой спрос также обусловлен низкой стоимостью материала.
Вещество активно используют и в других сферах:

- Соединение бария отличается мощной яркостью при покрытии им поверхностей иных материалов. Окись металла часто применяют в пиротехнике и добавляют в состав эмалей и глазурей для декоративной облицовки, чтобы получить зелёный цвет.
- Оксид нередко используют в качестве катализатора для проведения химических реакций. Обычно оно необходимо для осаждения чистого бария, а также получения пероксида и гидроксида.
- Вещество применяется в сочетании с редкоземельными металлами и окисью меди при производстве керамики, используемой при низких температурах.
- Соединение может выступать одним из главных элементов в составе стёкол специфичных направлений: BaO позволяет производить непроницаемый материал для рентгеновских установок.
Оксид бария выступает в роли электролитного компонента в составе фторионных аккумуляторных батарей. Он используется в отрасли атомно-водородной и ядерной техники. Материалом покрывают урановые стержни. Он незаменим при производстве оптических приборов (призм, линз) и антикоррозийных поверхностей. Кроме того, вещество применяют при разработке и создании оборудования в медицинской сфере.
Номенклатура
-Оксид бария
-Окись бария
Способ получения
1.Гидроксид бария вступает в взаимодействие с углекислым газом и образует карбонат бария и воду:
2.Оксид бария вступает в взаимодействие с углекислым газом при комнатной температуре с образованием карбоната бария:
3.Хлорид бария вступает в реакцию с концентрированным раствором карбоната натрия и образует карбонат бария и хлорид натрия:
Важнейшие соединения
Как и все типичные металлы, барий вступает в химическую реакцию с кислородом, при этом полученное вещество зависит от условий процесса и катализатора. Например, простая реакция окиси с водой дает возможность образовывать Ba(OH)2 — гидроксид бария. Оксид бария получают из нитрата. Типичны соединения со всеми галогенами: BaF2, BaCI2, BaI2, BaS, BaBr2. Образование нитратов, сульфидов, сульфатов, происходит за счет взаимодействия минералов с соответствующими кислотными растворами. На сегодняшний день все важнейшие соединения бария находят свое применение. Но исключить новые открытия в сферы использования данного вещества нельзя, с ростом технологичности приборов его значение будет только возрастать как на промышленном, так и на бытовом уровне.

Физическое состояние
Желтовато-белое кристаллическое вещество.
Оксиды
Бинарная связь химического элемента с кислородом наиболее распространенная форма вещества в природе. При этом оксиды образуют металлы и неметаллы. Именно характеристика элемента при взаимодействии с кислородом стала основой формирования периодической системы Менделеева Д. И. Для металлургической отрасли наиболее приемлемым способом выделения вещества является процесс его получения из оксида. Предварительно металлическая природная руда (соли металлов) подвергается различным химическим воздействиям, направленным на получение окиси. Как правило, данный процесс сопровождается нагреванием до необходимой температуры. Исключением не является и оксид бария. Формула полученного вещества имеет вид: BaO. Оксиды можно получить и другими способами. Например, из гидроксидов, солей и самих оксидов более высокой степени окисления.

Физические свойства:
| 200 | Физические свойства | |
| 201 | Плотность | |
| 202 | Температура плавления | |
| 203 | Температура кипения | |
| 204 | Температура сублимации | |
| 205 | Температура разложения* | |
| 206 | Температура самовоспламенения смеси газа с воздухом | |
| 207 | Удельная теплота плавления (энтальпия плавления ΔHпл) | |
| 208 | Удельная теплота испарения (энтальпия кипения ΔHкип) | |
| 209 | Удельная теплоемкость при постоянном давлении | |
| 210 | Молярная теплоёмкость | |
| 211 | Молярный объём | |
| 212 | Теплопроводность | |
| 213 | Коэффициент теплового расширения | |
| 214 | Коэффициент температуропроводности | |
| 215 | Критическая температура | |
| 216 | Критическое давление | |
| 217 | Критическая плотность | |
| 218 | Тройная точка | |
| 219 | Растворимость в воде и иных жидкостях | |
| 220 | Давление паров (мм.рт.ст.) | |
| 221 | Давление паров (Па) | |
| 222 | Стандартная энтальпия образования ΔH | |
| 223 | Стандартная энергия Гиббса образования ΔG | |
| 224 | Стандартная энтропия вещества S | |
| 225 | Стандартная мольная теплоемкость Cp | |
| 226 | Энтальпия диссоциации ΔHдисс | |
| 227 | Диэлектрическая проницаемость | |
| 228 | Магнитный тип | |
| 229 | Точка Кюри | |
| 230 | Температура Нееля | |
| 231 | Объемная магнитная восприимчивость | |
| 232 | Удельная магнитная восприимчивость | |
| 233 | Молярная магнитная восприимчивость | |
| 234 | Электрический тип | |
| 235 | Электропроводность в твердой фазе | |
| 236 | Удельное электрическое сопротивление | |
| 237 | Сверхпроводимость при температуре | |
| 238 | Критическое магнитное поле разрушения сверхпроводимости | |
| 239 | Запрещенная зона | |
| 240 | Концентрация носителей заряда | |
| 241 | Твёрдость по Моосу | |
| 242 | Твёрдость по Бринеллю | |
| 243 | Твёрдость по Виккерсу | |
| 244 | Скорость звука | |
| 245 | Поверхностное натяжение | |
| 246 | Динамическая вязкость газов и жидкостей | |
| 246 | Взрывоопасные концентрации смеси газа с воздухом, % объёмных | |
| 247 | Взрывоопасные концентрации смеси газа с кислородом, % объёмных | |
| 248 | Предел прочности на растяжение | |
| 249 | Предел текучести | |
| 250 | Предел удлинения | |
| 251 | Модуль Юнга | |
| 252 | Модуль сдвига | |
| 253 | Объемный модуль упругости | |
| 254 | Коэффициент Пуассона | |
| 255 | Коэффициент преломления |
Риски
Может быть токсичным при проглатывании. Он не должен попадать на кожу. Раздражает глаза, кожу и дыхательные пути. Это может быть вредно для нервной системы. Он способен вызывать низкий уровень калия, что приводит к сердечным и мышечным заболеваниям.
Меры безопасности
Оксид металла нельзя транспортировать рядом с пищевыми продуктами, косметическими средствами, кормами для животных и разными водными организмами. На фасовке со средством обязательно присутствует один из символов:
- Xn — раздражающее воздействие отмеченного соединения;
- R20/22 — опасность при вдохе или проглатывании оксида;
- S17 — хранение средства на максимальном расстоянии от горюче-смазочных материалов;
- S28 — незамедлительное промывание водой кожного покрова при случайном попадании на него вещества.

Средство с барием выпускают в упаковках по 1, 20−25, 100, 500 и 1000 кг. Фасовкой служат стеклянные банки, полипропиленовые мешки или полиэтиленовые пакеты. На любой упаковке обязательно указывают класс степени опасности 5:1. На некоторых фасовках может присутствовать значение вторичной опасности — 6:1.
Опасное вещество требует особых условий хранения. Оксид бария нужно держать подальше от легко возгораемых средств, восстанавливающих агентов, металлов в порошкообразном виде. Рядом с веществом не должны находиться продукты питания и корма для сельскохозяйственных животных.
Окись бария была изучена со многих сторон. Но учёные стараются найти ему и другое применение. Возможно, что в скором будущем появятся новые технологии, которые будут связаны с этим веществом.
Понравилась статья? Поделитесь ей
А какая Ваша оценка этой статьи?
12345
3.3 из 5
Доска почета
Чтобы сюда попасть — пройдите тест
При изготовлении керамики
BaO используется в композициях для покрытия керамической глазури.

Однако он также был испытан в качестве добавки при получении стеклокерамики.
BaO эффективно улучшает механические характеристики и химическую стойкость этого типа керамики. Он оказывает сильное влияние на термические свойства и состав кристаллической фазы получаемых материалов.
Особые обозначения на упаковке
Полностью исключена одновременная транспортировка с пищевыми продуктами, косметической продукцией, животными кормами и любыми водными организмами. Весь транспортируемый материал должен быть помечен следующими символами:
- • Хn, обозначающий раздражающее действие отмеченных веществ;
- • R, с числовым значением 20/22, что говорит об опасности при вдохе и в случае проглатывания;
- • S, с числовым значением 17, что предписывает ранение вещества в максимальной отдаленности от горюче – смазочных материалов;
- • S, с числовым значением 28, указывающем на незамедлительное промывание, в случае попадания ВаО на поверхность кожных покровов.
Варианты фасовки подразумевают распределение вещества по упаковкам в 1, 20 – 25, 100, 500 и 1000 килограммовые упаковки, которыми служат банки из стекла, мешки из полипропилена, пакеты из полиэтилена. На фасовке любого веса обязателен к указанию класс степени опасности: 5.1. Существует понятие вторичной опасности, означаемой 6.1.
Ba(OH)2 + CO2 = ? уравнение реакции
Срочно нужна помощь! Подскажите, возможна ли реакция взаимодействия между гидроксидом бария и углекислым газом (Ba(OH)2 + CO2 = ?)? Запишите молекулярное и ионное уравнения реакции. Охарактеризуйте полученное нерастворимое в воде соединение: приведите его основные физические и химические свойства.
В результате пропускания углекислого газа через раствор гидроксида бария (Ba(OH)2 + CO2 = ?) произошло образование средней соли – карбоната бария и воды. Молекулярное уравнение реакции имеет вид:
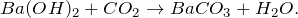
Карбонат бария представляет собой вещество белого цвета, кристаллы которого при нагревании на воздухе разлагаются. Плавится под избыточным давлением углекислого газа. Не растворяется в воде. Частично переводится в раствор избытком углекислого газа. Разлагается разбавленными кислотами.
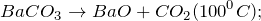
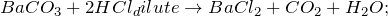
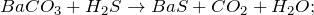
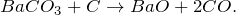
Основной промышленный способ получения карбоната бария – использование минерального сырья, в частности минерала витерита. В лабораторных условиях, кроме вышеописанной реакции применяют действие углекислого газа или карбоната натрия на сульфид бария:
Источник
Особенности гидроксида и пероксида бария
Гидроксид бария обозначается, как Ba(OH). Применяется в виде кристаллообразных пластин белого цвета, либо в состоянии раствора, более известного как баритовая вода. Популярен в стекольном производстве, например для создания и разработки непроницаемого стекла для рентгеновских установок. Также используется в производстве керамических изделий, в процессах по очистке воды и в производстве гидроксида калия.

Пероксид бария, обозначаемый, как BaO, получается путем нагревания оксида бария в воздушном пространстве с характерным отсутствием диоксида углерода.
приложений
Оксид бария используется в качестве осушителя бензина и растворителей. Используется в качестве покрытия для горячих катодов, например, электронно-лучевых трубок.
Оксид свинца (II) был заменен при производстве определенных типов стекла, таких как оптическое коронное стекло.
В 1884 году было обнаружено, что оксид бария имеет эффект повышения показателя преломления без увеличения дисперсии, свойство, которое оказалось более ценным при разработке фотографических линз, известных как анастигматические линзы (линзы, лишенные астигматической аберрации)..
В то время как оксид свинца повышал показатель преломления, также увеличивалась дисперсионная способность, которую оксид бария не изменяет (Rudolf Kingslake, 2016).
Оксид бария также используется в качестве катализатора этоксилирования в реакции этиленоксида и спиртов, которая происходит при температуре от 150 до 200 ° С..
Он также является источником чистого кислорода из-за тепловых колебаний. Легко окисляется до BaO1 +х путем образования пероксид-иона.
Полное перекисное окисление BaO до BaO2 происходит при умеренных температурах, но увеличение энтропии молекулы O2 при высоких температурах означает, что BaO2 Разлагается в O2 и БаО до 1175 К.
Реакция использовалась в качестве крупномасштабного метода для производства кислорода, прежде чем разделение воздуха стало доминирующим методом в начале 20-го века.
Метод был назван в честь его изобретателей процесса Брина. Эта реакция была использована Жюлем Верном в его книге «от земли до луны», чтобы главные герои дышали внутри «машины».
Хотя реакция является правильной со стереометрической точки зрения, Верн не учел, что источник тепла, используемый для реакции, — пламя, израсходованный кислород..
Описание физических свойств ВаО
Существует в твердом состоянии. Непосредственно сам барий отличается характерным серебристо – белым оттенком, достаточно пластичен, по причине чего относится к ковким металлам.
- • Величина молярной массы оксида бария, гр/моль: 153, 3394;
- • По плотности вещество характеризуется следующими показателями, при условии температурного режима в 20 °C: 5, 72;
- • Растворимость в воде, то есть показатель Кs, при условии температуры в 20° С = 1, 5 г/100 г;