Угольная кислота — свойства, получение и применение. Физические и химические свойства угольной кислоты
Физические и химические свойства
Угольная кислота способна существовать в равновесии с диоксидом углерода в водных растворах. Однако при изменении условий, в частности, температуры, этот карбонатный класс склонен распадаться, одновременно происходит окисление гидроксида. Также встречается безводная форма, которая представляет собой небольшие бесцветные кристаллы, образующиеся при температурах ниже минус 30 градусов. При ее нагревании происходит диссоциация угольной кислоты, при которой твёрдая форма полностью разлагается.

Соляный ангидрид свое название получил из-за формулы угольной кислоты, в которой содержится СО2. Газ может подвергаться обратному гидролизу, создавая устойчивую кислую среду. В растворах, содержащих эти элементы, возникает равновесная сложная система, которая сохраняет свою химическую формулу и физические свойства. При повышении температуры стабильность и равновесие такого раствора нарушается, а кислота начинает разлагаться. Полностью этот процесс завершается при кипячении водного раствора.
Угольная кислота, графическая формула которой выглядит как H2CO3, имеет нейтральную реакцию, образуя кислые и средние соли, в том числе гидрокарбонаты и карбонаты. На сегодняшний день это вещество отлично изучено, химикам известна степень, молярное уравнение, масса, константа и степень валентности. Такие соединения получили широкое распространение в пищевой промышленности, их используют в качестве консервантов и раскислителей, а также в бытовой химии для изготовления различных чистящих и моющих средств.
Структурная формула

Но стоит отметить тот факт, что во время разложения гидрокарбоната аммония, формируются устойчивые соединения угольной кислоты. Такие крепкие химические связи образуются только в период, когда гидрокарбонат аммония вступает в газовую фазу реакции.
Вещество является интересным объектом для изучения. Его изучают австралийские ученые уже более 6 лет. В безводном состоянии эта кислота напоминает прозрачные кристаллы, которые имеют высокую стойкость к низким температурам, но при нагревании кристаллы угольной кислоты начинают разлагаться.

Данное вещество считается слабым по своей структуре, но в тоже время, угольная кислота является сильнее борной. Весь секрет заключается в количестве атомов водорода. В составе угольной кислоты имеется два атома водорода, поэтому она считается двухосновной, а борная кислота — одноосновная.
Чистое твердое вещество
Сказанное выше позволяет сделать вывод: из решения H2CO3 нет возможности синтезировать эту кислоту в виде чистого твердого вещества обычным методом. Однако это делается с 90-х годов прошлого века, исходя из твердых смесей CO2 и H2ИЛИ.
К этой твердой смеси CO2-ЧАС2Или на 50% он бомбардируется протонами (разновидность космического излучения), так что ни один из двух компонентов не улетучивается и происходит образование H.2CO3. Для этого смесь CH3OH-CO2 (помните α-H2CO3).
Другой метод — сделать то же самое, но только с использованием сухого льда.
Из трех методов ученые НАСА смогли прийти к одному выводу: чистая углекислота, твердая или газообразная, может существовать на ледяных спутниках Юпитера, в марсианских ледниках и кометах, где такие твердые смеси постоянно облучаются. космическими лучами.
Синтез
Молекула
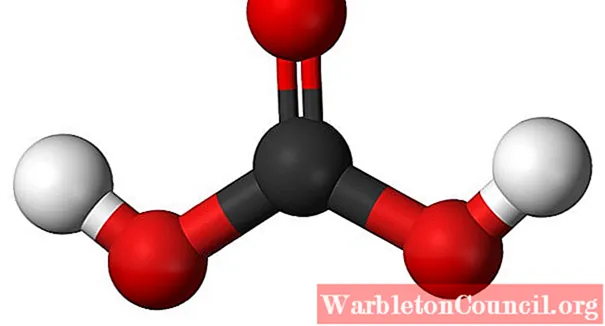
Выше мы видим молекулу H2CO3, представленный сферами и стержнями. Красные сферы соответствуют атомам кислорода, черные — атому углерода, а белые — атомам водорода.
Обратите внимание, что из изображения вы можете написать еще одну действительную формулу этой кислоты: CO (OH)2, где CO — карбонильная группа C = O, связанная с двумя гидроксильными группами OH. Поскольку есть две группы OH, способные отдавать свои атомы водорода, теперь понятно, откуда берутся ионы H.+ выпущен до середины.
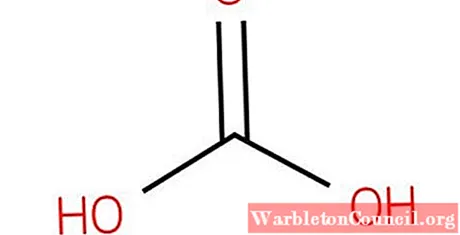
Также обратите внимание, что формула CO (OH)2 можно записать как OHCOOH; то есть типа RCOOH, где R в данном случае представляет собой группу ОН.
По этой причине, в дополнение к тому факту, что молекула состоит из атомов кислорода, водорода и углерода, которые слишком распространены в органической химии, некоторые считают угольную кислоту органическим соединением. Однако в разделе, посвященном его синтезу, будет объяснено, почему другие считают его неорганическим и неорганическим по природе.
Молекулярные взаимодействия
Молекулы H2CO3 Можно сказать, что его геометрия представляет собой тригональную плоскость с углеродом, расположенным в центре треугольника. В двух своих вершинах он имеет группы ОН, которые являются донорами водородных связей; а в другом оставшемся — атом кислорода группы C = O, акцептор водородных связей.
Таким образом, H2CO3 он имеет сильную тенденцию взаимодействовать с протонными или кислородсодержащими (и азотистыми) растворителями.
По совпадению, вода соответствует этим двум характеристикам, и таково сродство H2CO3 для нее, которая почти сразу ставит ей H+ и начинает устанавливаться равновесие гидролиза, в котором участвуют частицы HCO3– и H3ИЛИ+.
Вот почему простое присутствие воды расщепляет угольную кислоту, что затрудняет ее выделение как чистое соединение.
Способы получения
Наибольшее распространение на сегодняшний день получила технология изготовления кислоты угольной путем растворения в воде структурной газовой формы диоксида углерода. Для производства этих соединений используют соответствующие установки, позволяющие увеличивать давление углекислоты, одновременно понижая температуру раствора. В подобных условиях концентрация угольной кислоты увеличивается и в последующем имеется возможность получения твердой формы за счёт понижения температуры до отметки -35 градусов и ниже.

Также в последние годы популярностью стала пользоваться технология производства солей путем взаимодействия гидрокарбонатов и карбонатов с еще более сильными кислотами. При этом лучшая часть полученных соединений разлагается на диоксид углерода и воду. Преимуществом такой технологии является простота используемого оборудования, не требуется одновременно охлаждать растворы и повышать давление CO2, но при этом отмечается большое количество отходов. Недостатком этой технологии является то, что требуется утилизировать углеродный диоксид, который превращается в пар.
Используемые сегодня высокотехнологичные установки позволяют получать чистую кислоту угольную, в особенности при применении технологии с экстремально низкими температурами. В последующем необходимо лишь обеспечить правильное хранение кристаллов, которые при температурах выше минус 30 градусов начинают растворяться, быстро теряя все свои свойства. Также возможно производство и последующее хранение различных солей на основе этого соединения, которые сохраняют свою форму и параметры даже при положительных температурах и доступе воздуха.
Особенности солей угольной кислоты
Эта кислота считается двухосновной, поэтому может создавать соли двух видов:
- • карбонаты угольной кислоты – средние соли,
- • гидрокарбонаты – кислые соли.
Карбонатами угольной кислоты могут выступать в соединения: Na2СO3,(NH4)2CO3. Они не способны растворятся в водной среде. Кислые соли этого вещества включают в себя: бикарбонаты NaHCO3 , Ca(HCO3)2. Для получения гидрокарбонатов производят реакцию, в которой основными веществами являются: угольная кислота и натрий.

Соли угольной кислоты помогли человечеству в строительстве, медицине и даже кулинарии. Потому что они встречаются в составе:
- • мела,
- • пищевой, кальцинированной и кристаллической соды,
- • известняковой породы,
- • мраморного камня,
- • поташа.
Гидрокарбонаты и карбонаты кислоты могут вступать в реакции с кислотами, во время этих реакции возможно выделение углекислого газа. Также эти вещества могут быть взаимозаменяемыми, они способны разлагаться под воздействием температуры.
Реакции угольной кислоты:
2NaHCO3 → Na2CO3 +H2O +CO2
Na2CO3 + H2O + CO2 →2NaHCO3
Физические свойства, внешний вид, формула
Структурная формула и молекула угольной кислоты
Угольная кислота — это равновесный раствор, в котором преобладает разложение с образованием двуокиси углерода. Химическая формула кислоты – H2CO3. Молекула располагается в пространстве на плоскости. Положение отдельных функциональных частей описывается sp2– гибридизацией – перекрывание атомных орбиталей (область пребывания электрона, электронное облако) – sp и p. Sp2-разновидность предполагает накладывание p-орбиталей и одной sp, они направлены к вершине треугольника под углом 120 °.
Ангидрид имеет вид твёрдых кристаллов без цвета и запаха с характерным кисловатым вкусом. Переходит из твёрдого состояния в газообразное при -30 °С. Не подвержен ультрафиолетовому излучения, избыточной влажности при низких отрицательных температурах. При подогревании дестабилизируется, в дальнейшем отмечается термолиз.
Растворение
Угольная кислота — одно из самых простых для синтеза соединений. Как? Самый простой метод — превратить выдыхаемый нами воздух в объем воды с помощью соломинки или соломинки. Потому что мы, по сути, выдыхаем CO2, он будет пузыриться в воде, растворяя небольшую ее часть.
Когда мы это делаем, происходит следующая реакция:
CO2(г) + H2O (l) <=> H2CO3(ac)
Но, в свою очередь, следует учитывать растворимость CO.2 в воде:
CO2(g) <=> CO2(ac)
Оба СО2 как H2O — неорганические молекулы, поэтому H2CO3 с этой точки зрения он неорганичен.
Равновесие жидкость-пар
В результате мы имеем систему в равновесии, которая сильно зависит от парциальных давлений CO.2, а также температуру жидкости.
Например, если давление CO2 увеличивается (в случае, если мы продуваем воздух через соломинку с большей силой), образуется больше H2CO3 и pH станет более кислым; так как первое равновесие смещается вправо.
С другой стороны, если нагреть раствор H2CO3, растворимость CO снизится2 в воде, потому что это газ, и тогда равновесие сместится влево (будет меньше H2CO3). То же самое будет, если мы попытаемся создать вакуум: CO2 он улетит, как молекулы воды, что снова сместит баланс влево.
Состав
Химические свойства, реакции
Растворы угольной кислоты реагируют с активными металлами щелочноземельного ряда и соответствующими гидроксидами, образуя карбонаты:
H2CO3 + Ca → CaCO3 + H2↑
Угольная кислота проявляет типичные для кислот свойства, взаимодействуя с основными оксидами. Оксид кальция переходит в соль угольной кислоты:
H2CO3 + CaO → CaCO3 + H2O
Схожие продукты наблюдаются при взаимодействии с гидроксидом кальция:
H2CO3 + Ca(OH)2 → CaCO3↓ + 2H2O
Угольная кислота реагирует с гидроксидами, давая начало бикарбонатам:
H2CO3 + NaOH → NaHCO3 + H2O
Реакция с гидроксидом может пойти и по другому пути, в результате выделяется карбонат:
H2CO3 + NaOH → Na2CO3 + H2O
Другие соли угольной кислы формируются при смешивании её растворов с карбонатами:
H2CO3 + CaСO3 → Ca(HCO3)2
Раствор угольной кислоты реагирует с силикатами, образуется осадок кремневой кислоты:
H2CO3 + Na2SiO3 → H2SiO3↓ + Na2CO3
Термолиз либо смешивание с жидкостью приводит к распадению, оксид улетучивается:
H2CO3 → CO2↑ + H2O
Диссоциация (расщепление на ионы) идёт в несколько обратимых этапов:
- H2CO3 → H+ + HCO3–
Первая ступень приводит к образованию протонов водорода и гидрокарбонат-иона, заряженного отрицательно.
- HCO3– → H+ + CO32-
Вторая, заключительная, стадия характеризуется образованием карбонат-иона, который имеет не поделённые электроны.
Индикатором произошедшей диссоциации служит покрасневшая лакмусовая бумажка. Посредством лакмуса – красящего пигмента, нанесённого на целлюлозу, известен в химии как pH-индикатор, краснеющий в кислой среде и синеющий – в щелочной. Высокая концентрация положительно заряженного водорода способствует закислению.
Особенности применения
Угольная кислота и её соли сегодня активно используются в различных сферах жизнедеятельности человека. Они применяются в медицине, строительстве и кулинарии. Без этих микроэлементов невозможно было бы получение и возникновение следующих составов и материалов:
- мраморный камень;
- известняковые породы;
- кристаллическая и пищевая сода;
- мел;
- поташ.
Также из кислоты угольной получают углекислый газ, который требуется для изготовления газированной воды. Свойства этих соединений изменять показатели давления в зависимости от содержания ионов и кислотности позволяют на их основе выпускать хладагенты для морозильников и солнечных генераторов.

Такие кислоты и соли широко используются в пищевой промышленности, они полностью безопасны для организма человека. Из нее делаются разнообразные консерванты, которые не ухудшают свойства продуктов питания, существенно продлевая их срок хранения. Это соединение используется в качестве антиокислителя, его добавляют в кофе, чай и сыры. С открытием этой кислоты появилась возможность изготавливать разнообразные шипучие напитки, в том числе минералку, Coca- Cola и даже шампанское.
В последние годы широкое распространение получила литиевая соль, которую изготавливают из этой кислоты. Она применяется для производства керамических изделий, также ее добавляют в топливо для реактивных двигателей. Сегодня это химическое соединение активно применяется в стекловарении. На его основе выполняют специальные добавки, которые повышают прочность и эксплуатационные характеристики конечного материала. Силикатное стекло, в которое была добавлена литиевая соль, отличается не только прочностью, но и великолепными показателями проницаемости светового потока.
Кислоту угольную активно используют пожарные бригады, что позволяет им эффективно бороться с огнём. В жидком виде такие соединения содержат в специальных емкостях, после чего под высоким давлением направляют в распылители, смешивая со специальными химикатами, образующими густую пену. Это позволяет не только бороться с открытым пламенем, но и быстро тушить горящую нефть и различные нефтепродукты.
Использование в сельском хозяйстве
Кислота угольная сегодня широко используется в сельском хозяйстве для производства различных качественных минеральных удобрений. Это экологически чистые компоненты, которые применяются для подкормки различных овощных, фруктовых и плодовых культур, позволяя существенно повысить показатели урожайности.
На основе кислоты угольной выполняются следующие минеральные удобрения:
- кальцинированная сода;
- литиевая соль;
- карбамид или мочевина.

Наибольшее распространение сегодня получила мочевина или как она стала сегодня называться карбамид. Это простое в использовании эффективное удобрение, которое отличается универсальностью. С одинаковым успехом его можно вносить под плодовые деревья, фрукты и овощи, различные декоративные растения.
Несомненным преимуществом таких удобрений на основе угольной кислоты является доступная стоимость минеральных составов, их простота использования, эффективность и полная экологичность.
Получение, уравнение угольной кислоты
Безводная угольная кислота
В лаборатории раствор угольной кислоты производится посредством растворения соответствующего оксида:
CO2 + H2O → CO2 ∙ H2O → H2CO3
Реально получение угольной кислоты из ее солей через добавление к ним более сильных кислот, металлы вытесняются, отделяется белёсый осадок, раствор мутнеет, образуется взвесь мелкодисперсных хлопьев:
Na2CO3 + 2HCl → 2NaCl + H2CO3↓
Поскольку в растворенной форме она не способна существовать долгое время, запускается реакция разложения.
В промышленных условиях получение ведётся, как правило, через низкопроцентные газы. Для этого используют соду, а также поташ, обработку гидроксидами. Протекает реакция обмена, формируется раствор угольной кислоты.
Средняя стоимость
На сегодняшний день в России имеется несколько крупных производителей кислоты угольной, которые изготавливают как соли, так и чистые вещества. В среднем стоимость одного килограмма такого соединения составляет 3−4 тысячи рублей.

Также востребован мел, который изготавливают с использованием этой кислоты, он применяется в кормовых и технических целях. За одну тонну мела обычно просят 1200 рублей.
В редких случаях используется так называемый угольный снег, то есть кристаллы твердой формы этой кислоты. Они имеют крайне высокую стоимость, доходящую до 10000 рублей за килограмм и более. При этом необходимо обеспечить соответствующие условия хранения, в том числе поддержание температуры на уровне минус 30−35 градусов, что предупреждает его разложение. Это соединение применяется в химической промышленности, а также при производстве разнообразных продуктов питания.
Понравилась статья? Поделитесь ей
А какая Ваша оценка этой статьи?
12345
Доска почета
Чтобы сюда попасть — пройдите тест
Приложения
Сама по себе угольная кислота — бесполезное соединение. Однако из его растворов можно приготовить буферы на основе пар HCO.3–/ CO32- или H2CO3/ HCO3–.
Благодаря этим растворам и действию фермента карбоангидразы, присутствующего в красных кровяных тельцах, CO2 Вырабатываемый при дыхании, он может переноситься с кровью в легкие, где, наконец, высвобождается для выдоха за пределы нашего тела.
Бурление CO2 он используется для придания безалкогольным напиткам приятного и характерного ощущения, которое они оставляют в горле при их употреблении.
Аналогично, наличие H2CO3 Это имеет геологическое значение в формировании сталактитов известняка, так как медленно растворяет их, пока они не образуют свою остроконечную поверхность.
С другой стороны, его растворы можно использовать для приготовления некоторых бикарбонатов металлов; Хотя для этого выгоднее и проще напрямую использовать бикарбонатную соль (NaHCO3, например).